北京大学肿瘤医院内蒙古医院下设药物临床试验机构办公室,办公室主要负责药物临床试验的承接审核和过程监督管理;审核批准药物临床试验的重要决策与规范制度;审核研究者发起的重要国内或国际多中心临床研究的科学性。
药物临床试验机构办公室会对申请的临床试验进行线下审核,流程如下:
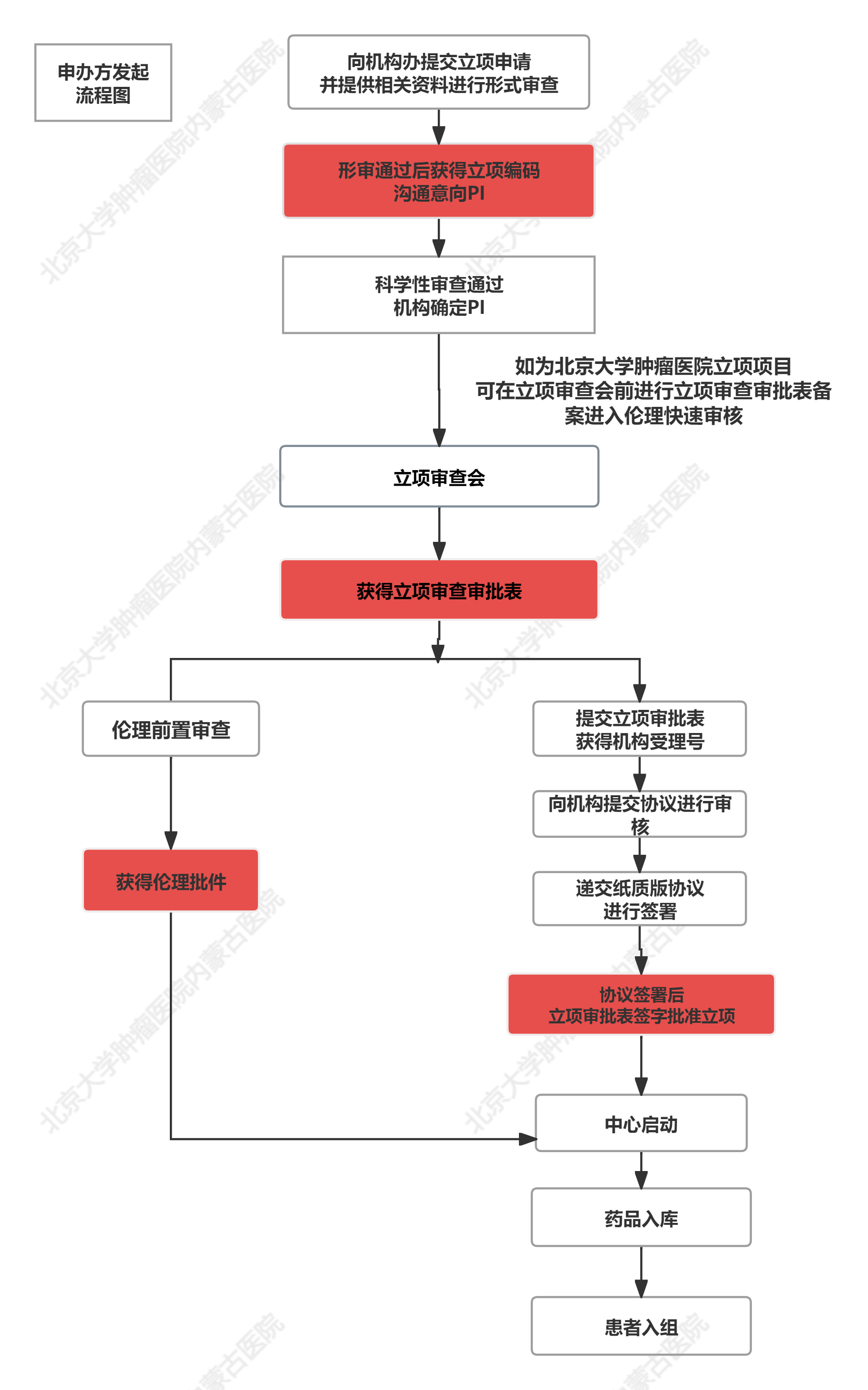
一、申办方发起的项目:
1.申办方向机构办公室提交相关内容完成申请(nmgzlyyGCP@126.com),电话:0471-3281464,联系人陈复、李彩霞;提交内容详见附件1(立项相关要求及资料)。如为北京大学肿瘤医院本院已开展项目,立项审查开通绿色通道,享有优先审核,优先办理的政策。
2.形式审查通过后获得立项编码。
3.申办方浏览我院PI库,沟通提供意向PI人选。
4.通过形式审核项目提交到机构办公室负责人葛赛,进行初步科学性审查,通过后提交到机构主任张小田,确定初步科学性审查通过,确定PI。
5.如为北京大学肿瘤医院本院已开展项目,确定PI后获得立项审批表备案,提交伦理进行快速审核。
6.召开立项审查会:目的为沟通科学性、我院实施可行性、方案实施细节。(1)召开时间:每周三下午(2)参加人员:GCP机构成员,研究PI,研究护士,GCP药师,申办方相关人员等(3)材料提供:方案简介实施幻灯(4)召开地点:科室办公室。申办方向机构缴纳立项审查费用3180元(含税),医院向申办方开具正式发票。
7.经立项审查会会研究决定可以承接的项目需提交立项审批表和立项资料(附件2),获得机构受理号。同时进入伦理审查阶段,持立项审查会审批表即可申请伦理上会。
8.机构对协议进行审核。
9.递交纸质协议相关资料。
10.签署协议,相关负责人在立项审批表签字后批准立项。
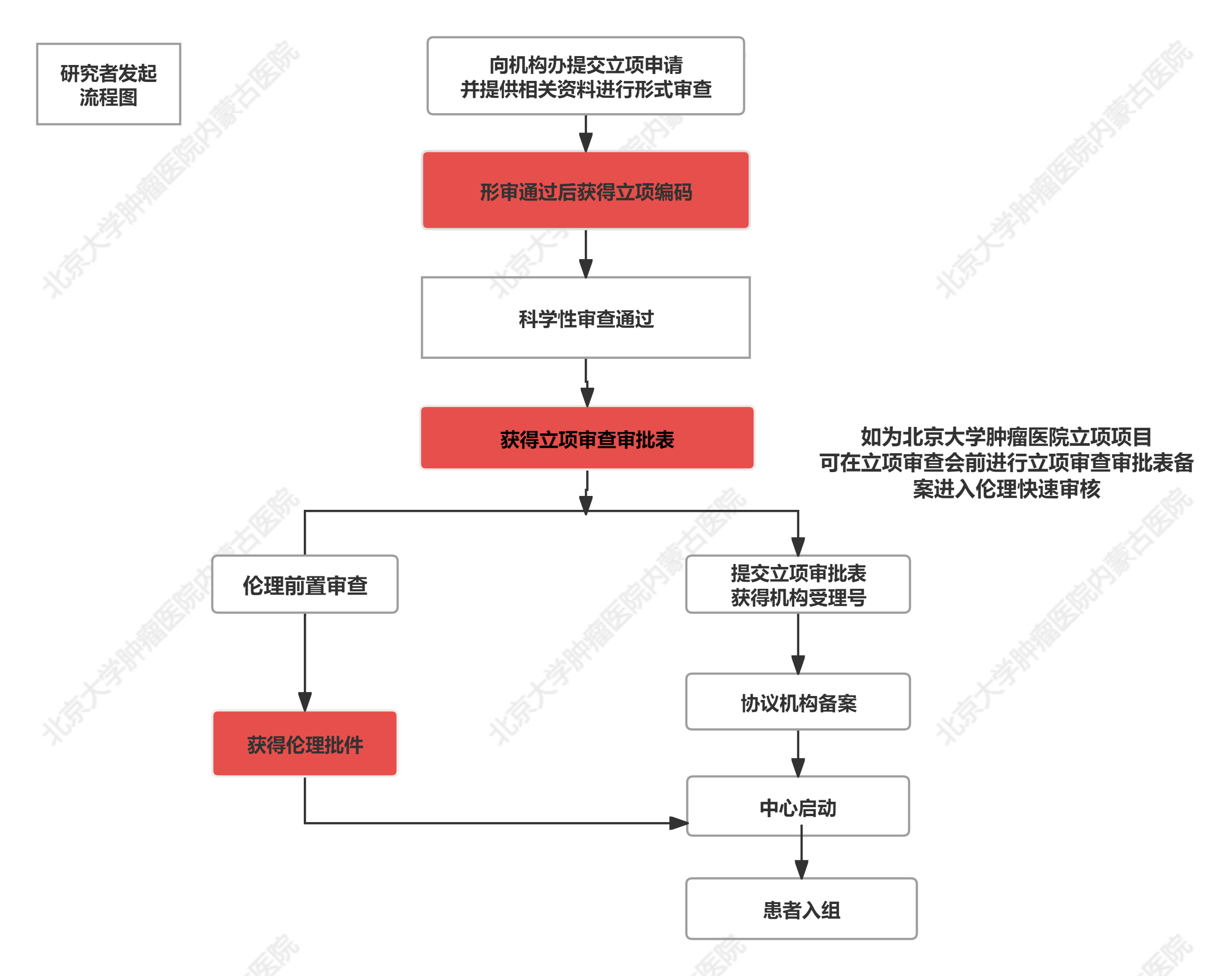
二、研究者发起的项目:
1.研究者向机构办公室提交相关内容完成申请(nmgzlyyGCP@126.com),电话:0471-3281464,联系人陈复、李彩霞;需提交的项目资料参见附件3,进行形式审核(约7个工作日);如为北京大学肿瘤医院本院已开展项目,同时提交主中心伦理委员会批件,立项审查开通绿色通道,享有优先审核,优先办理的政策。
2.通过形式审核后,机构递交到机构办公室负责人葛赛,进行科学性及可行性审核(约7个工作日);
3.机构办负责人向机构主任汇报,经机构办公室备案后同意立项,进入伦理审查阶段。如为北京大学肿瘤医院本院已开展项目,获得立项资料审批备案表,提交伦理进行快速审核。
三、有以下情形之一的,不得予以立项审核:
1、违反法律、法规、规章的相关规定
2、违背伦理原则或科研诚信原则
3、研究前期准备不足,临床研究时机尚不成熟
4、相关药品、医疗器械可能存在质量缺陷
5、临床研究的安全风险超出可控范围
6、研究负责人与研究结果有直接利益关系
7、可能存在商业贿赂或其他不当利益关系
8、可能侵犯他人知识产权
9、依据法律法规和国家有关规定应当禁止研究的其他情形
网址:www.nmgzlyy.com 地址:呼和浩特市赛罕区昭乌达路42号
版权所有:北京大学肿瘤医院内蒙古医院•内蒙古医科大学附属肿瘤医院